Barncancerfonden är den enskilt största finansiären av barncancerforskning och 2023 var året då de sammanlagda satsningarna sedan starten för över 40 år sedan passerade fyramiljardersvallen. Nu delar Barncancerfonden ut 125 miljoner kronor till 62 projekt inom barncancerområdet med målet att varje drabbat barn ska överleva och leva ett gott liv.
Barncancercentrum Drottning Silvias barnsjukhus, Foto: Sofia Sabel.
Barncanceröverlevnaden har i Sverige, liksom i stora delar av västvärlden, under 2000-talet ökat till 85 procent, men flera stora utmaningar kvarstår. Dels finns fortfarande flera svårbehandlade cancerformer, dels drabbas så många som 7 av 10 barn av sena komplikationer orsakade av behandlingen och en tredjedel av dessa är riktigt allvarliga, till och med livshotande.
De projekt som beviljas medel speglar de behov som finns menar Britt-Marie Frost, Barncancerfondens forskningschef.
– Det handlar mycket om att genom ny teknik och tillgång till mer genetisk information kunna minska både över- och underbehandling, men också hitta nya läkemedel som immunterapier och precisionsläkemedel som vi sedan kan kombinera på olika sätt för bättre effekt. Behovet av att få fram nya läkemedel och mer individanpassade behandlingar är stort. Vi måste få tillgång till fler av de nya typer av läkemedel som nu utvecklas för att testa och godkänna för barn.
2023 fick Barncancerfonden 147 projektansökningar varav 62 (42%) beviljas medel för, oftast under de tre kommande åren. Av de beviljade projekten är cirka 70 procent fortsättningsbidrag och 30 procent projekt med en ny frågeställning.
Ett av de områden där överlevnaden är lägre och de sena komplikationerna allvarliga är hjärntumörer.
– Vi har flera tumörtyper som drabbar hjärnan och nervsystemet. Många av dessa är idag mycket svårbehandlade och tyvärr orsakar tumören och flera av behandlingsmetoderna komplikationer i olika grad. Det kan handla om en speciell form av hjärntrötthet – cancer fatigue, koncentrationssvårigheter, minnesstörningar och i vissa fall påverkan på IQ. Detta orsakar problem som ofta påverkar barnet resten av livet, säger Britt-Marie Frost.
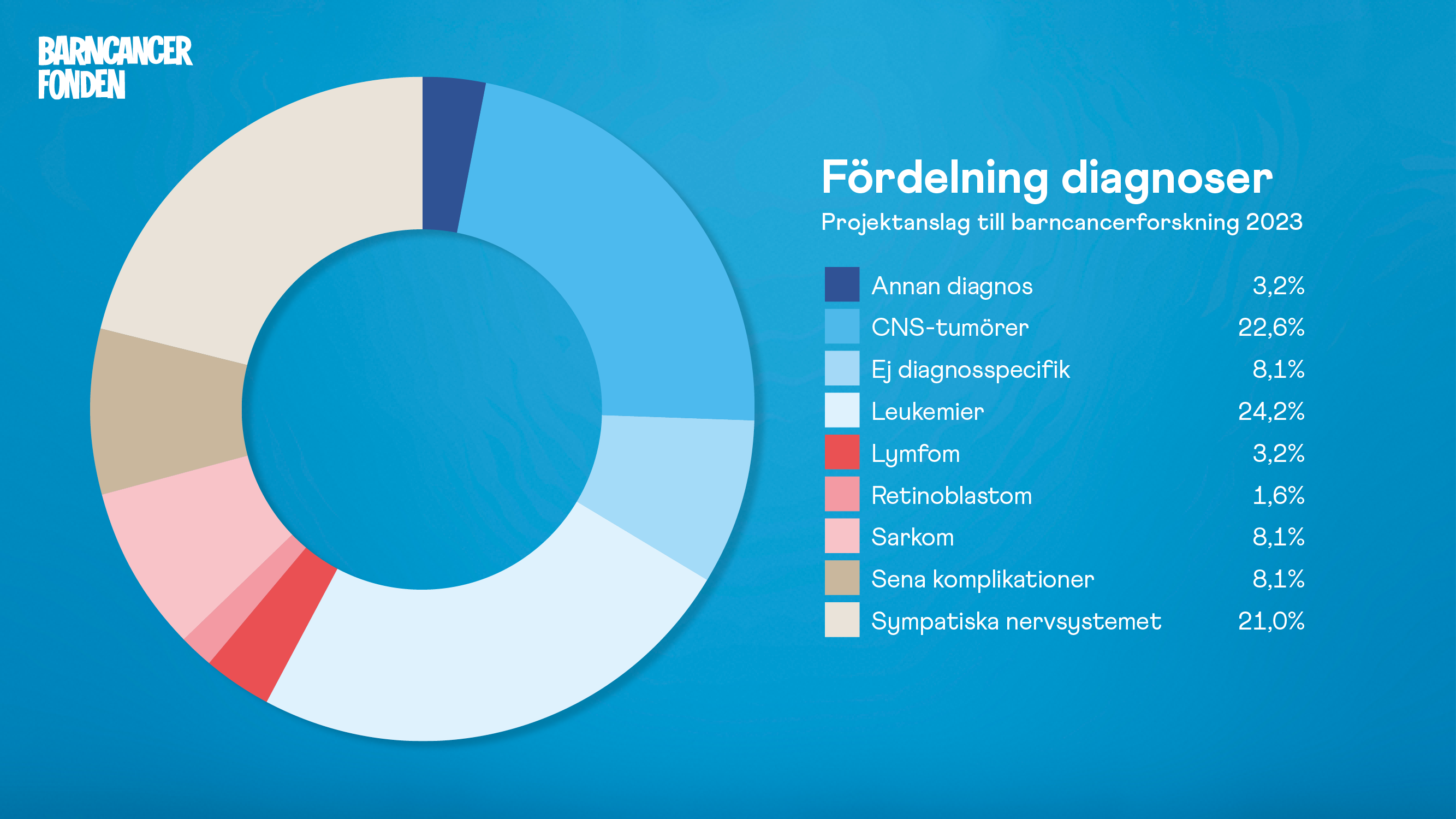
Projektanslag 2023 fördelat på diagnoser.
Tillsammans med hjärntumörer är leukemi den vanligaste diagnosgruppen och trots bättre behandlingsmetoder finns där stora utmaningar.
– Dagens leukemibehandling är lång och väldigt komplex. Vi ser nu när överlevnaden har ökat att många får svåra och ibland livslånga komplikationer. Vi ser också återfall där resistensutvecklingen gör det svårt att behandla så det är en viktig diagnos att fortsätta forska inom. Sverige har under de senaste åren lett det internationella leukemiprotokollet ALLTogether som innehåller både vårdriktlinjer och forskning. Där inkluderas många barn med lymfatisk leukemi och får anpassad behandling utifrån deras individuella risk för att drabbas av återfall.
Trots de många utmaningar som finns inom området är Britt-Marie Frost positiv.
– Det händer så mycket spännande inom cancerområdet och inom barnonkologin ligger vi faktiskt före vuxenonkologin i den bemärkelsen att vi nu erbjuder helgenomsekvensering till alla barn med cancer för att kunna ställa en mer exakt diagnos, vilket är en förutsättning för en mer individanpassad behandling.
De 10 projekt som fick mest medel 2023 är:
- Magnus Essand, Uppsala universitet: CAR-T celler med förmåga att inducera immunitet i hjärntumörer hos barn
- Fredrik Swartling, Uppsala universitet: Ursprungsceller, återfallsmekanismer och nya genterapier för barnhjärntumörer
- Sven Nelander, Uppsala universitet: Nya behandlingar mot cancer i nervsystemet hos barn: en integrativ strategi
- Thoas Fioretos, Lunds universitet: Förbättrad molekylär förståelse, diagnostik och behandling av akut leukemi hos barn
- Daniel Bexell, Lunds universitet: Nya behandlingsvägar mot terapiresistent neuroblastom
- Marika Nestor, Uppsala universitet: Utveckling av molekylär strålterapi för neuroblastom med hjälp av målsökande läkemedel
- Rikard Wicksell, Karolinska institutet: DAHLIA-ung: en behovsanpassad digital behandling för unga med långvarig smärta efter cancersjukdom
- Fredrik Mertens, Lunds universitet: Genetiska studier av mjukdelstumörer hos barn
- Kjeld Schmiegelow, Rigshospitalet, Region Hovedstaden: Thioguanine förbättrad ALL-underhållsbehandling
- Caroline Apergi Palm, Karolinska institutet: Utveckling av RNAi prodroger för precisionsmedicin mot barnleukemi
Bland universiteten gick mest medel till Karolinska Institutet, följt av Uppsala universitet och Lunds universitet. Det universitetssjukhus som erhöll mest medel var Karolinska universitetssjukhuset.
Här finns listan på alla beviljade projekt.






