Immunterapi används allt mer som behandlingsmetod vid spridd cancer. Men på bröstcancer fungerar befintliga immunterapier inte så bra. Professor Karin Leandersson och hennes forskargrupp arbetar med att ta reda på varför. Det arbetet, som inkluderar att studera det mänskliga immunförsvaret på cell- och molekylär nivå, kan nu accelerera tack vare pengar från Lundbergs Forskningsstiftelse som går till inköp av en maskin för cellanalys. ”En oerhört viktig maskin för oss,” säger Karin Leandersson.

Karin Leandersson, foto Kennet Rouna
Varje år får omkring 1 500 kvinnor diagnosen spridd bröstcancer och cirka 5 500 lever med diagnosen. Behandlingsmetoderna utvecklas och det går idag att bromsa sjukdomen, men inte alltid att bota den. Karin Leandersson är professor i tumörimmunologi på Clinical Research Center vid Lunds universitet. Hennes mål är att identifiera ännu okända mekanismer i immunförsvaret som påverkar cancerns spridning och därmed bidra till nya och bättre behandlingsstrategier för spridd bröstcancer.
Cancer strävar efter att sprida sig. Immunförsvaret känner igen och reagerar på cancerceller. Ofta leder det till att cancercellerna dödas. En viss form av immunterapi, som belönades med 2018 års Nobelpris i fysik eller medicin, går ut på att hindra immunförsvarets bromsar så att det blir ännu bättre på att bekämpa cancer. Det är en behandling som hjälper allt fler patienter med spridd tumörsjukdom. Men inte alla. Vid spridd bröstcancer verkar immunförsvaret göra tvärtom. Istället för att bli mer aktivt efter att ha identifierat en tumör så börjar det bromsa sin egen process.
Medfött och förvärvat immunförsvar
Människans immunförsvar består av två delar: Det medfödda systemet som aktiveras väldigt snabbt, och det förvärvade systemet som består av lymfocyter (vissa vita blodkroppar) och över tid bygger upp ett specifikt, immunologiskt minne – ett stärkt immunförsvar. Det förvärvade systemet styrs i hög grad av det medfödda systemet och det är lymfocyterna i det förvärvade systemet som är effektiva mot cancerceller.
Karin Leandersson leder ett forskningsprojekt som undersöker varför bröstcancer leder till ett nedtryckt immunförsvar.
”Vi studerar de medfödda immuncellernas bromsmekanismer och deras effekter på det förvärvade systemet och på patienternas tumörer. Dessutom undersöker vi om immunförsvaret aktivt påverkar spridningen av bröstcancer till ställen i kroppen där immunförsvaret inte kan komma åt cancern.”
Nya forskningsrön
Dagens kunskap om immunförsvarets roll vid cancer kommer i hög grad från studier på möss. Men Karin Leandersson och hennes medarbetare, som arbetar med blod- och vävnadsprover från cancerpatienter, har gjort den viktiga upptäckten att det inte alltid går att överföra den kunskapen till människor. I en del fall agerar immunförsvarets celler på motsatt sätt i människor jämfört med i möss.
”I det medfödda immunförsvaret finns vissa signalmolekyler som produceras snabbt för att gasa eller bromsa immunförsvaret. Vi har hittat en signalmolekyl som bromsar immunförsvaret i människa men gasar på immunförsvaret i möss. Forskningen har kommit långt på att studera möss men vi behöver bli bättre på att överföra den kunskapen till människa.”
Den nya insikten om skillnader i immunförsvaret hos människa respektive mus gör analyser av immunceller i prover från patienter – vilket är vad Karin Leandersson arbetar med – än viktigare. Det går att se mycket i ett enkelt blodprov och det är en stor fördel enligt Karin Leandersson.
”För att kunna analysera tumörceller krävs kirurgiska ingrepp och vävnadsprover. När det gäller immuncellerna räcker det oftast med ett blodprov, men inte alltid. Det hör till det vi undersöker – vad kan man få ut av medfödda immunceller i blod? Går de till exempel att använda som biomarkörer för ett visst stadie av sjukdomsprocessen?”
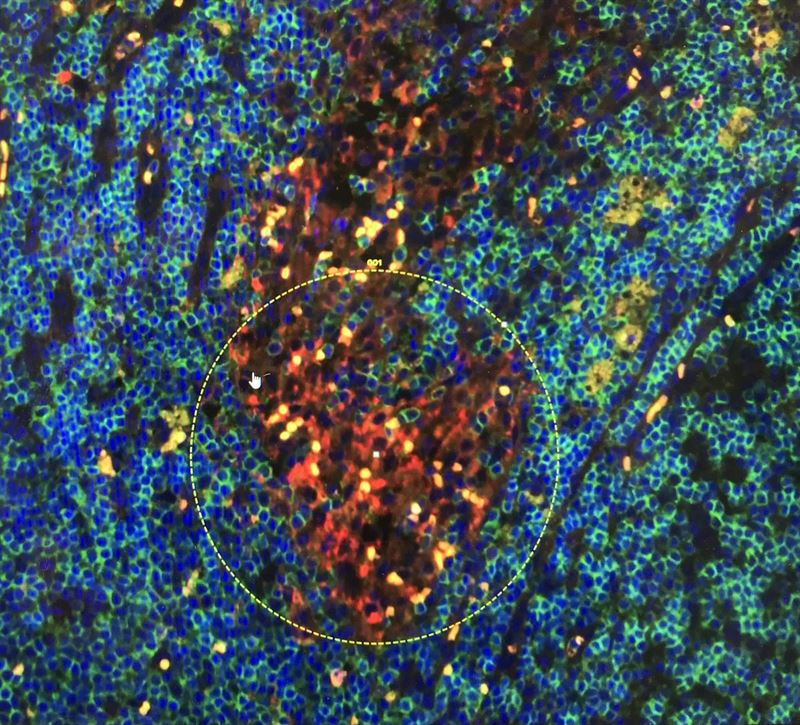
Bild som visar cancerceller (gula) och immunceller (röda makrofager och blå-gröna lymfocyter)
Ny utrustning avgörande
Tack vare en miljon kronor i stöd från Lundbergs Forskningsstiftelse kan Karin Leandersson och hennes forskargrupp nu köpa in en ny maskin för cellanalys. Med den kan forskarna skilja de olika cellerna åt och hitta just de celler som de vill studera.
”Den nya maskinen är helt avgörande för oss och nu prioriterar jag att driva fram inköpet så snabbt det går. Det handlar om en mycket central del av vårt arbete som inte är möjlig utan en bra utrustning för cellanalys.”
Väl på plats kommer den nya apparaturen att vara till nytta också för många andra cancerforskare på Clinical Research Center. Förutom bröstcancer handlar det om prostatacancer, koloncancer, cancer i bukspottskörteln med flera cancersjukdomar som drabbar många och som i sena stadier inte går att bota i nuläget.


