Incidensen av levercancer ökar över hela världen – nu presenteras nya rön som kan förbättra behandlingen
Forskare vid Karolinska Institutet har identifierat förekomsten av en specifik kombination av ett protein och en lncRNA-molekyl i levercancer. Genom att öka förekomsten av lncRNA-molekylen minskar tumörcellernas fettdepåer vilket leder till att tumörcellernas delning upphör, och att de så småningom dör. Studien, som publicerats i den framstående tidskriften Gut, bidrar till ökad kunskap som kan leda till bättre diagnos och framtida cancerbehandlingar. Docent Claudia Kutter skriver här om hur den nya kunskapen kan förbättra diagnostik och behandling av levercancer.
Levern är inte bara det tyngsta inre organet utan också den största körteln i människokroppen. De gamla grekerna trodde att levern är källan till liv, centrum för känslor och säte för själen. Redan år 300 f.Kr. postulerade den grekiske läkaren Herophilus av Chalcedon att levern tar näring från tarmen för att omvandla den till energi som distribueras via blodet till resten av kroppen. Även om Herophilus beskrivning är enkel, fångade den leverns centrala roll som en ”metabolisk koordinator”.
Idag vet vi, efter århundraden av noggrann forskning, att levern fungerar i hematopoes, det vill säga blodbildning, i det tidiga embryot och övergår i metaboliska och avgiftande funktioner senare i livet. Under den kontinuerliga processen att bryta ner giftiga ämnen kan levervävnaden skadas. Anmärkningsvärt nog har levern en oöverträffat hög förmåga att reparera sig själv. Men om denna självregenerativa kapacitet är uttömd är vägen mot irreversibla leversjukdomar satt. Cancer är den mest elaka leversjukdomen med över 905 000 nya fall per år över hela världen1. År 2030 förutspås en incidensökning på upp till 35 procent i många länder, inklusive Sverige, på grund av kroniska hepatitvirusinfektioner, ohälsosam livsstil eller exponering för cancerframkallande ämnen. Även genetiska faktorer bidrar till utveckling av levercancer2.
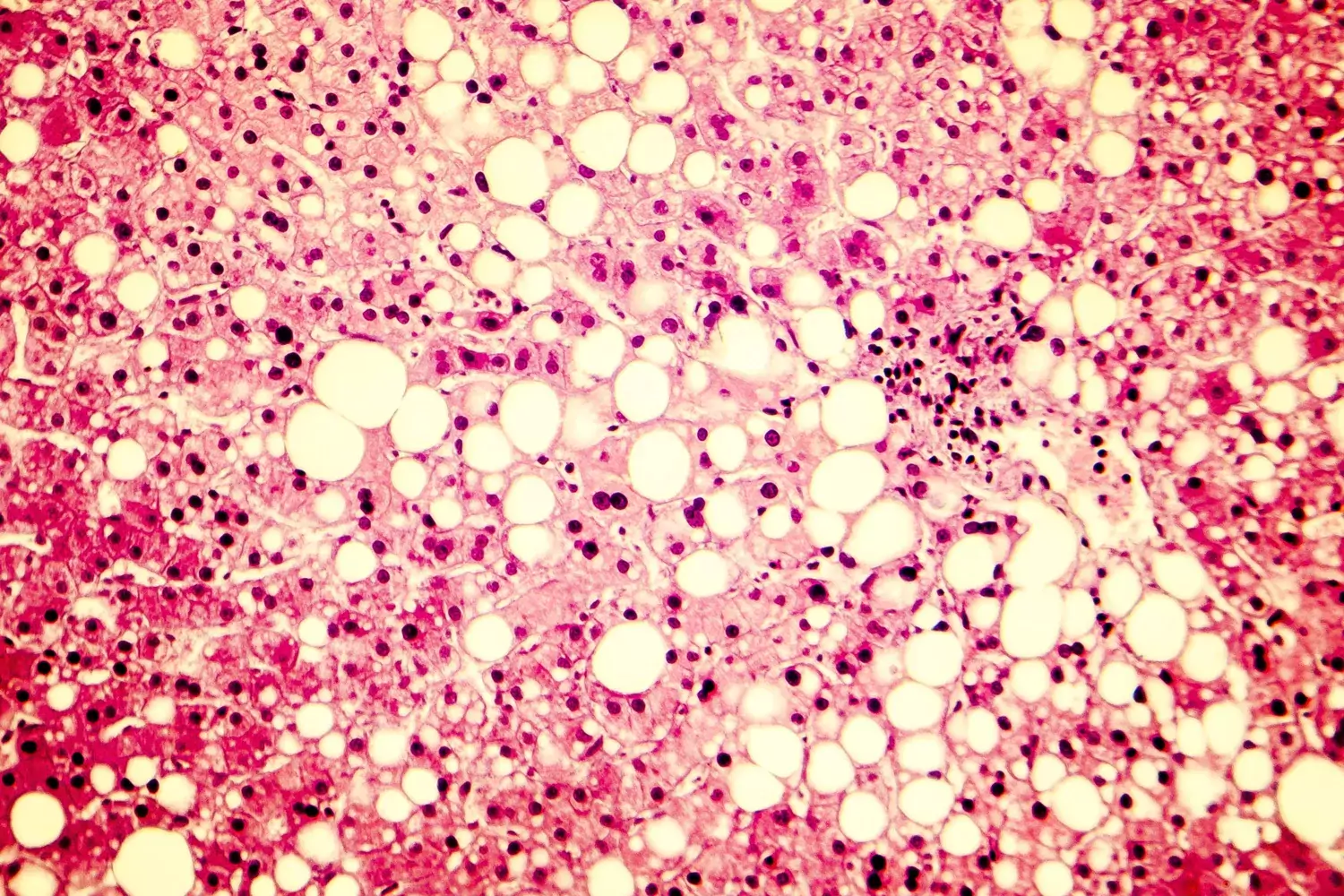
Primär levercancer omfattar en samling av kliniskt olika tumörsubtyper, där hepatocellulärt karcinom (HCC) drabbar 80 procent av alla diagnostiserade patienter1 och därmed är den vanligaste formen av levercancer. På histologisk nivå kännetecknas HCC av okontrollerad levercelltillväxt och -förökning, vilket bidrar till leverdysfunktion. Det saknas förståelse för de underliggande molekylära mekanismer som orsakar den onormala cellfenotypen, delvis eftersom HCC i allmänhet diagnostiseras i ett långt utvecklat stadium av sjukdomen. Endast en av fem patienter är fortfarande vid liv ett år efter diagnosen vilket gör HCC till en av de dödligaste cancertyperna1. Trots denna alarmerande statistik finns det bara ett fåtal behandlingsalternativ.
De flesta patienter upplever återfall efter operation, och de två godkända läkemedlen som hämmar tyrosinkinasaktivitet, sorafenib och lenvatinib, förlänger endast patienters medellivslängd med ett år3. Därför är det av största vikt att nya diagnostiska markörer och behandlingsalternativ utvecklas för primär levercancer.
HAR KOMPLEXA TRANSKRIPTOM
Celler har utvecklat sofistikerade sätt att kontrollera flödet av genetisk information från DNA via RNA till protein, vilket säkerställer korrekt cellfunktion och pålitlig överföring av genetiskt material. Onormalt genuttryck och transkriptbildning kan störa denna balans och leda till sjukdomar, såsom primär levercancer. Under de senaste decennierna har intensiv forskning fokuserat på att identifiera faktorer som bidrar till den fenotypiska mångfalden i cancerceller. Till exempel avslöjade profileringen av ett stort antal patientbiopsier distinkta RNA-signaturer för varje cancertyp och resulterade i mer exakt tumörtyp, stratifiering och sjukdomsprognos4. Även om den genetiska regleringen av RNA, kallad riboreglering, är väsentlig, förblir den exakta cellulära påverkan ofta understuderad.
Efter transkription interagerar en RNA-molekyl med RNA-bindande proteiner (RBP). RBP:er är viktiga enzymer för korrekt funktion av RNA-reglerande processer. Mutationer i RBP-gener förändrar interaktionen med RNA, vilket kan påverka eller leda till sjukdom. När ett RBP och RNA interagerar bildar de specialiserade ribonukleära komplex (RNP). Denna interaktion kan ske med hjälp av RNAbindande domäner som är distinkta strukturella enheter inom RBP. Proteiner med en känd RNA-bindande domän kallas kanoniska RBP. Intressant nog, genom tekniska framsteg, har många fler proteiner identifierats som binder RNA, trots att de saknar någon känd RNA-bindande domän. Sådana proteiner kallas icke-kanoniska RBP. För närvarande omfattar katalogen över kanoniska och icke-kanoniska RBP:er cirka 5 000 proteiner.
Det betyder att ungefär en fjärdedel av alla proteiner i människokroppen har potential att binda RNA och forskare har bara börjat förstå den fulla omfattningen av komplexiteten i RBP:s verkningssätt. Även om det är känt att RBP:er kan koordinera ett transkripts öde i många olika molekylära processer, allt från kromatinförpackning till mRNA-translation5, är det nödvändigt att karakterisera vilka RBP:er det gäller, och hur dessa bidrar till den varierande sammansättningen av transkript i cancerceller. Denna kunskap är väsentlig för att förbättra framtida RNA-baserade cancerbehandlingsstrategier.