Kolorektal cancer, KRC, är den tredje vanligaste cancersjukdomen i Sverige och världen, samt en av de mest dödliga. Nu ökar KRC. Här skriver onkologen Shabane Barot om orsaker, diagnos och överlevnad.

KRC förekommer främst i högindustrialiserade länder och är minst vanligt i Afrika söder om Sahara. En liten andel av alla fall uppstår till följd av nedärvda och direkt sjukdomsorsakande genetiska varianter, men upp till 30 procent av de som insjuknar har en ärftlighet för sjukdomen, så kallad familjär KRC. Det stora flertalet saknar dock helt ärftlighet och har därmed sporadisk sjukdom. I denna grupp drivs KRC-utvecklingen av omgivningsfaktorer. En rad ohälsosamma vanor som ökar risken för KRC har identifierats. Evidensen är starkast för rökning, alkoholöverkonsumtion, fysisk inaktivitet, övervikt eller obesitas samt en kost rik på rött och processat kött och fattig på fibrer och grönsaker.
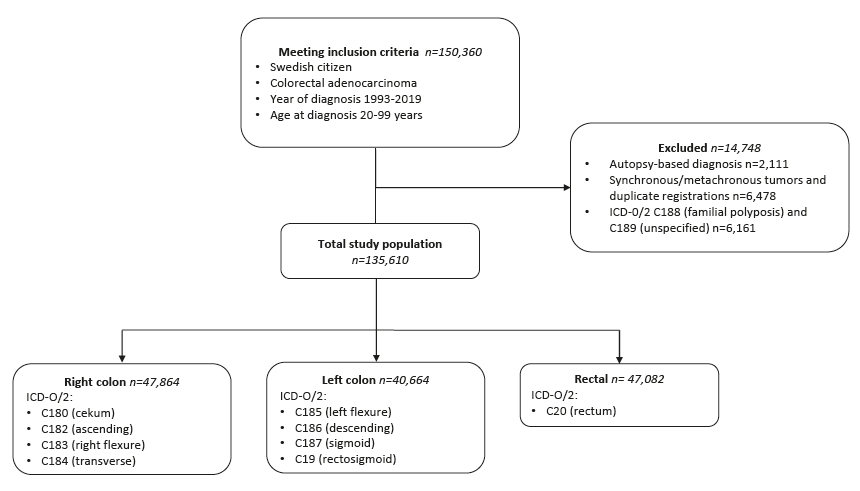
Figur 1: Flödesschema för studieinklusion enligt fördefinierade kriterier.
I flera av världens länder har incidensmönstren för KRC förändrats under de senaste decennierna. Bland vuxna yngre än 50 år har incidensen ökat i snabb takt, om än från låga nivåer. Detta kallas early-onset colorectal cancer, EOCRC, på engelska och är ett globalt fenomen. En tydlig så kallad födelsekohorteffekt kan observeras, där KRC ökar bland yngre vuxna i USA från mitten av 1980-talet och i Europa från tidiga 1990-talet. Trots att det är vanligare att personer med ärftlig cancer insjuknar tidigt i livet kan ökningen av EOCRC inte förklaras av genetiska faktorer.
Typiskt sett har patienter med EOCRC sporadisk sjukdom som engagerar vänsterkolon eller rektum. Distinkta tumörbiologiska skillnader mellan yngre och äldre patienter har inte identifierats. Vad som orsakar ökningen av EOCRC debatteras intensivt inom fältet. Omgivnings- och livsstilsfaktorer förefaller vara drivande även här. Obesitas och fysisk inaktivitet i barndomen, en ökande antibiotikaanvändning och förändrad kosthållning kan vara bidragande orsaker.
Bland äldre personer i världens höginkomstländer har distal koloncancer och rektalcancer minskat under samma period, medan högersidig koloncancer ökar. I många av dessa länder har KRC-screeningprogram införts, så även i Sverige där region Stockholm och Gotland startade år 2008-2009 och implementeringen på nationell nivå nu är i sitt slutskede. Införandet av screeningprogram påverkar såväl incidens som mortalitetsmönster för den berörda åldersgruppen, som i Sverige består av personer mellan 60-74 år.
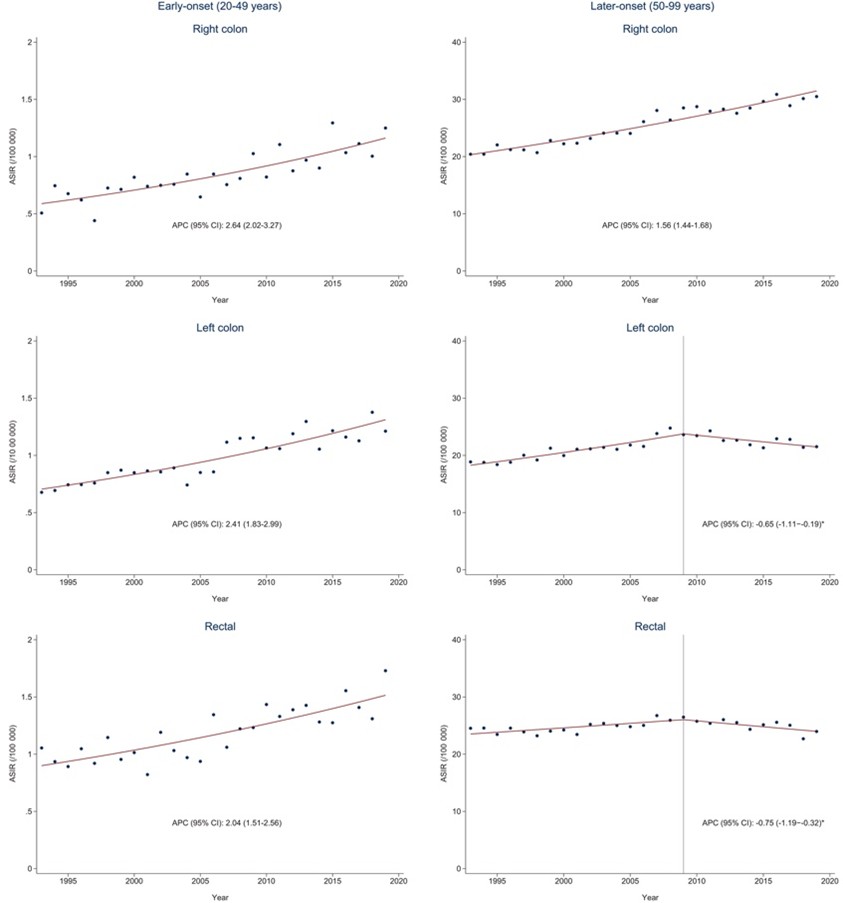
Figur 2: Age-standardized incidence rates (ASIRs) per 100 000 personår för kolorektal cancer under perioden 1993-2019, stratifierat på ålder. Till vänster: patienter 20-49 år. Till höger: patienter 50-99 år. Prickarna representerar estimat och de heldragna linjerna modellerade trender med angivna annual percentage change (APC:er) och korresponderande 95% konfidensintervall. Brytpunkter för vänstersidig kolon och rektalcancer är markerade med en heldragen vertikal linje.
Vad gäller prognos och överlevnad i de olika åldersgrupperna har tidigare studier rapporterat motstridiga resultat. EOCRC diagnostiseras oftare i sena stadier av sjukdomen. Inom många, men inte alla, studier har man observerat en förbättrad eller jämförbar stadiespecifik femårsöverlevnad för unga jämfört med äldre. Unga behandlas ofta mer intensivt än äldre, till exempel med adjuvant kombinationskemoterapi, även när det inte föreligger någon indikation enligt riktlinjer och vårdprogram. Överbehandling riskerar att leda till morbiditet och mortalitet på kort och lång sikt, men kunskapen om långtidsöverlevnad hos unga och gamla är bristfällig.
För att fylla denna kunskapslucka och studera incidenstrender bland yngre och äldre patienter med kolorektal cancer genomförde vi en registerbaserad studie av den svenska befolkningen. Vi använde det Nationella cancerregistret för att inkludera alla fall av kolorektal cancer diagnosticerade i Sverige mellan åren 1993-2019 (figur 1).
Av de 47,864 fall av högersidig koloncancer som inkluderades utgjordes 1719 (4%) av EOCRC. För vänstersidig koloncancer (totalt 40,664) och rektalcancer (totalt 47,082) var motsvarande siffra 5% (figur 1). Incidensen av EOCRC ökade för såväl höger- som vänstersidig koloncancer och rektalcancer under studieperioden (figur 2). Inom den äldre gruppen, bestående av 50-99 åringar, ökade högersidig koloncancer, medan vänstersidig kolon- och rektalcancer minskade från omkring år 2009.
Vid en jämförelse av den stadiespecifika relativa överlevnaden i de olika åldersgrupperna fann vi en bättre relativ överlevnad inom den yngre gruppen. Skillnaden var mest uttalad vid metastaserad sjukdom (figur 3). Vi studerade även överdödligheten bland yngre och äldre KRC-patieentere upp till 10 år efter diagnos och fann en långvarig kvarvarande överdödlighet inom båda grupperna.
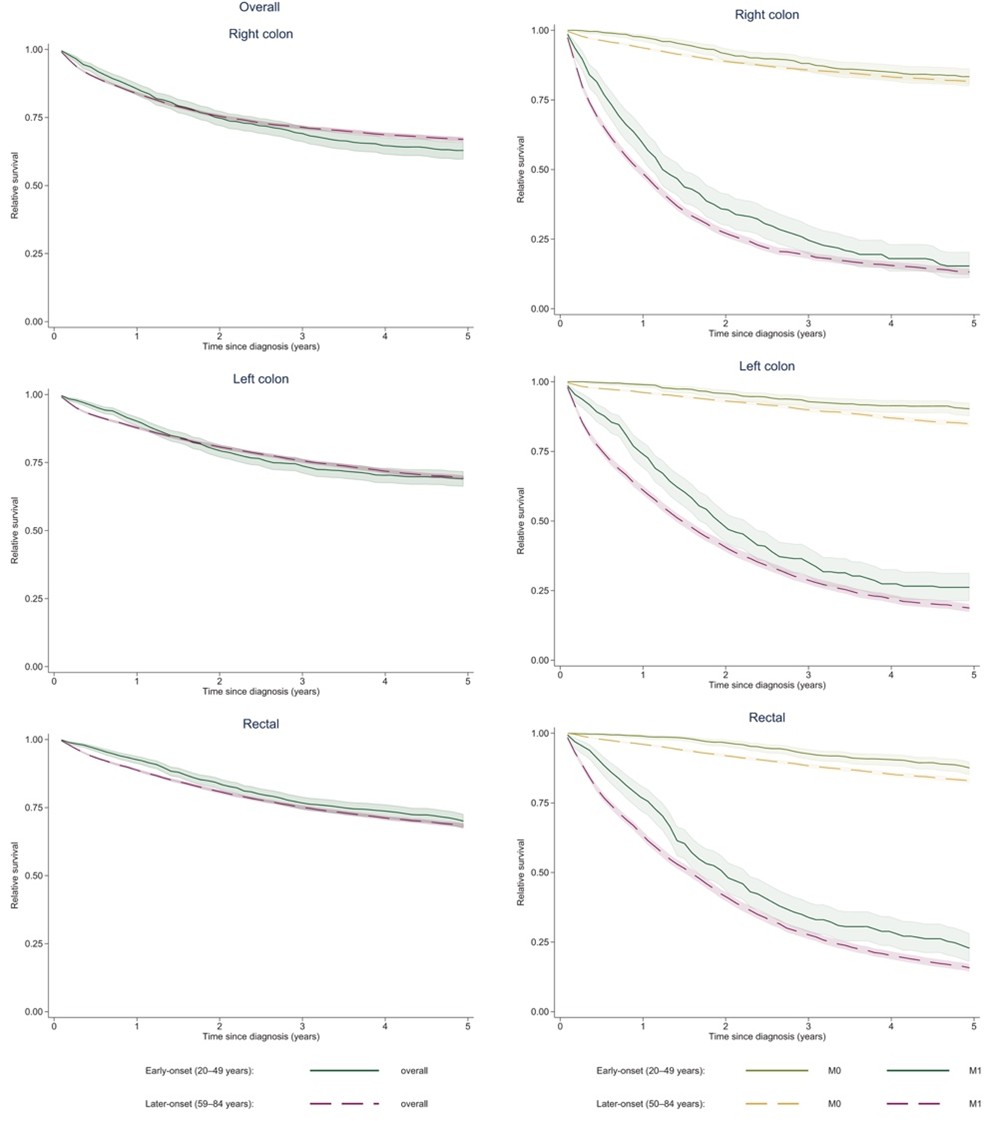
Figur 3: Relativ 5-års överlevnad för patienter diagnostiserade med kolorektal cancer år 2007-2019, ojusterat till vänster och stratifierat på ålder och stadium (M0 respektive M1) till höger. Heldragna linjer representerar patienter 20-49 år och streckade linjer gruppen 50-99 år.
I denna studie fann vi sammanfattningsvis att EOCRC ökat i Sverige under de senaste decennierna, vilket speglar en global trend. Yngre patienter har en förbättrad stadiespecifik överlevnad, vilket delvis kan bero på att de i högre utsträckning erhåller kurativt syftande kirurgisk och onkologisk behandling vid lokalt avancerad och även spridd sjukdom.
Bland äldre patienter minskar distal kolon- och rektalcancer, vilket inte riktigt kan förklaras av implementeringen av KRC-screening i region Stockholm och Gotland under studieperioden, även om man kan tänka sig att upptäckt och behandling av polyper kan ha bidragit till en minskad incidens (en ökning av antalet diagnostiserade fall i tidigt stadium är samtidigt att förvänta).
Bland såväl yngre som äldre patienter med kolorektal cancer kunde vi observera en kvarstående överdödlighet 5-10 efter diagnos, ett något överraskande fynd. Huruvida detta beror på senbiverkningar av given behandling, nya primära maligniteter, sena återfall eller delade riskfaktorer med t.ex. kardiovaskulär sjukdom återstår att se. Dödsorsakerna behöver kartläggas så att vi kan utveckla förbättrade uppföljningsprogram, som tillåter oss att vidta åtgärder som kan förebygga dödsfall inom gruppen canceröverlevare, där andelen yngre personer förväntas växa.
REFERENSER
Blom J, Saraste D, Tornberg S, et al: Routine Fecal Occult Blood Screening and Colorectal Cancer Mortality in Sweden. JAMA Netw Open 7:e240516, 2024
Cardoso R, Guo F, Heisser T, et al: Colorectal cancer incidence, mortality, and stage distribution in European countries in the colorectal cancer screening era: an international population-based study. Lancet Oncol 22:1002-1013, 2021
Cercek A, Chatila WK, Yaeger R, et al: A Comprehensive Comparison of Early-Onset and Average-Onset Colorectal Cancers. J Natl Cancer Inst 113:1683-1692, 2021
Carbone F, Spinelli A, Ciardiello D, et al: Prognosis of early-onset versus late-onset sporadic colorectal cancer: Systematic review and meta-analysis. Eur J Cancer 215:115172, 2025
Fontana E, Meyers J, Sobrero A, et al: Early-Onset Colorectal Adenocarcinoma in the IDEA Database: Treatment Adherence, Toxicities, and Outcomes With 3 and 6 Months of Adjuvant Fluoropyrimidine and Oxaliplatin. J Clin Oncol 39:4009-4019, 2021
Gupta S, May FP, Kupfer SS, et al: Birth Cohort Colorectal Cancer (CRC): Implications for Research and Practice. Clin Gastroenterol Hepatol 22:455-469 e7, 2024
Leary JB, Hu J, Leal A, et al: Risk Without Reward: Differing Patterns of Chemotherapy Use Do Not Improve Outcomes in Stage II Early-Onset Colon Cancer. JCO Oncol Pract 21:333-340, 2025
Patel SG, Karlitz JJ, Yen T, et al: The rising tide of early-onset colorectal cancer: a comprehensive review of epidemiology, clinical features, biology, risk factors, prevention, and early detection. Lancet Gastroenterol Hepatol 7:262-274, 2022
Siegel RL, Torre LA, Soerjomataram I, et al: Global patterns and trends in colorectal cancer incidence in young adults. Gut 68:2179-2185, 2019
Sung H, Siegel RL, Laversanne M, et al: Colorectal cancer incidence trends in younger versus older adults: an analysis of population-based cancer registry data. Lancet Oncol 26:51-63, 2025
Vuik FE, Nieuwenburg SA, Bardou M, et al: Increasing incidence of colorectal cancer in young adults in Europe over the last 25 years. Gut 68:1820-1826, 2019
Text: Shabane Barot