»Min drivkraft är att hjälpa andra«
En stark röst kan användas till mycket. Susanne Dieroff Hay, som har varit ordförande för Bröstcancerförbundet i sju år, har använt sin till att se till att förbundet blivit en mäktig röst att räkna med när det gäller bröstcancervården i landet. När den årliga Bröstcancerrapporten släpps, lyssnar hela Sjukvårds-Sverige. I år varnar rapporten för vad bristen på kompetensutveckling bland bröstonkologer kan leda till för landets bröstcancerpatienter. Förutom det starka engagemanget i förbundet höjer numera Susanne Dieroff Hay, som själv har haft bröstcancer, även sin röst i andra sammanhang – som sångerska och keyboardist i ett rockband.
Alla människor har en historia att berätta brukar det heta, och Susanne Dieroff Hay är med sin lite ovanliga livsresa inget undantag. Det hörs inte riktigt på henne idag men hon föddes i Karlstad för 63 år sedan och bodde där fram till gymnasiet. Mamman var svensk och pappa kom från Baden-Württemberg i södra Tyskland.
– Mina föräldrar träffades i Tyskland på 50-talet. Min mamma tillbringade ett år där och sedan flyttade pappa efter till Sverige. I familjen pratade vi alla tyska med varandra, eller snarare schwäbiska, som var pappas lite svårbegripliga sydtyska dialekt. Mamma tyckte att det var lika bra att utbilda sig till lärare i tyska och jag började som 15-åring på en internationell skola för flickor i Heidelberg för att lära mig ”riktig” tyska, berättar Susanne, som blev kvar i fyra år och tog studenten där.
Hennes främsta intressen under skolåren var musik och konst och hon beskriver sig som raka motsatsen till en plugghäst, åtminstone under grundskoleåren.
– Då gjorde jag nog mest bara det jag gillade men under åren i Tyskland pluggade jag så ögonen blödde till långt in på kvällen. Annars hade jag inte klarat skolan, konstaterar hon, och tillägger att hon inte riktigt hade en aning om vilket yrke hon så småningom skulle välja.
– Mest av allt ville jag bli sångerska men det sade pappa nej till. Min konstlärare, underbara Frau Doktor Peters, upptäckte dock att jag hade en konstnärlig begåvning och det ledde till att jag flyttade till Hamburg och utbildade mig inom grafisk design och formgivning under fyra år.
Det var fyra roliga år men så småningom började hon längta hem till Sverige.
– Jag sökte jobb på olika reklambyråer i Sverige men hamnade på Brindfors i Düsseldorf där jag träffade min skotske man som var AD (art director) där. 1988 flyttade vi tillbaka till Sverige och jag började arbeta på en annan byrå, Stockholms enskilda reklambyrå.
Mammans svåra olycka
1990, när Susanne var gravid med sitt första barn, flyttade familjen till Karlstad. Och där inträffade en traumatisk händelse som kom att påverka henne i många år.
– Min mamma, som då var 54 år, ramlade i en trappa och fick mycket svåra hjärnskador. Hon låg på intensiven och jag på BB, det var en fruktansvärd tid, säger Susanne och berättar att hennes mor hamnade i koma och avled efter två år.
Under de här åren gick även mormor bort och familjen Dieroff Hay flyttade till Glumslöv i Skåne. Livet rullade på och 1994 föddes barn nummer två, en dotter.
– Det var lite svåra tider jobbmässigt. När min pappa dog 1997 hoppade min bror och jag in och avvecklade hans olika företag. Under min studietid i Hamburg hade han bland annat en pianofabrik i Arvika. För att finansiera mina studier sålde jag svenska Malmsjö/Jahn pianon i Tyskland, berättar Susanne och skrattar lite vid minnet.
Pappa gick bort i cancer och eftersom han hade utryckt en stark önskan om att inte bli obducerad hittades aldrig den primära tumören. Det var i samband med pappans sjukdom men även under mammans långa vårdtid som Susanne upplevde brister i sjukvården. Där såddes fröet till det starka engagemang som hon kom att utveckla under de kommande åren.
– Jag insåg hur viktigt det är att man lyssnar på både patienten och anhöriga.
Efter pappans död flyttade familjen till London och senare till USA, men Skåne, hästgården i Glumslöv, var den plats på jorden där samtliga familjemedlemmar trivdes bäst. Under de närmaste åren fortsatte- och intensifierades- kontakterna med sjukvården.
– Min man fick först njurcancer 2007 och några år senare tarmcancer. 2008, när jag vikarierade som bildlärare, fick jag bröstcancer, berättar Susanne, som minns hur hon efter sjukdomsbeskedet gick ut med sina hundar och satte sig på en sten med en förlamande tomhetskänsla i kroppen.
SwAIPP2: AI-baserad diagnostik för framtidens cancerbehandling
VINNOVA har nyligen satsat 95 miljoner SEK på sex innovationsmiljöer som i samverkan ska ta fram banbrytande lösningar för framtidens hälsooch sjukvård och stärka Sveriges position inom området på den globala arenan. Ett av dessa projekt är SwAIPP2: Swedish AI Precision Pathology2. Här skriver professor Johan Hartman och forskningssamordnare Emelie Karlsson vid Karolinska Institutet, om precisionsdiagnostik och att utveckla en AI-baserad analys för riskstratifiering av bröstcancer.
Swedish AI Precision Pathology-projektet är en fortsättning på en tidigare framgångsrik Vinnova-satsning som syftar till att implementera AI-baserad cancerdiagnostik i sjukvården. Grunden för projektet utgörs av Sveriges ledande roll inom digitaliseringen av patologi. Initialt fokuserade projektet på bröstcancer, vilket är ett fält som kan ses som en ”role model” där utvecklingen av AI-baserade diagnostiklösningar har kommit allra längst. I nästa steg tar SwAIPP2 klivet mot att applicera AI-lösningen på andra stora cancerformer.
Varför bröstcancer?
Bröstcancer är den vanligaste cancerformen hos kvinnor globalt med drygt 2,3 miljoner nydiagnostiserade fall varje år. I Sverige insjuknar 1 av 10 kvinnor i bröstcancer någon gång under sin livstid, vilket ställer höga krav på en välfungerande diagnostik.
Patologen har en central roll i bröstcancerdiagnostiken och ansvarar för den tumörbiologiska bedömningen. I klinisk rutin för bröstcancer analyserar patologen fyra prognostiska och i vissa fall behandlingsprediktiva biomarkörer: östrogenreceptorn (ER), progesteronreceptorn (PR), HER2 och Ki67. Tumörgraden, som anges på en tregradig skala, är starkt prognostiskt och avgörande för att kunna klassificera en bröstcancers aggressivitet. En utmaning är att ca 50% av alla tumörer klassificeras som tumörgrad 2, en stor mellangrupp utan klinisk relevans. Studier har visat att grad 2-tumörer inte kan klassificeras som en tumörbiologiskt definierad undergrupp, utan i stället delas de in i två distinkta grupper baserat på genuttryck, vilka var för sig är närmast identiska med grad 1- respektive grad 3-tumörer.
Bröstcancer kan vidare delas in i undergrupper baserat på molekylära karaktäristika, där den största gruppen har ett positivt ER-uttryck (ER+) och ett negativt HER2-uttryck (HER2-). För onkologens arbete spelar tumörgraden hos ER+/HER2- bröstcancer en extra viktig roll, vilket innebär att tilläggsanalyser ofta behövs för behandlingsbeslut för cancrar inom denna grupp som utgörs av tumörgrad 2.2
Dagens utmaningar med riskstratifiering av bröstcancer
Cancerforskningens framsteg har lett till ett gradvis skifte mot en precisionsbaserad diagnostik, med målet att kunna ge en individanpassad vård och behandling. Ett exempel är genexpressionsprofilering (GEP), vilket är en analys som främst används för ER+/HER2- bröstcancer med tumörgrad 2 (och i vissa fall även för ER+/ HER2- bröstcancer med tumörgrad 3). GEP prognosticerar vilka av dessa bröstcancrar som har en låg respektive hög risk för återfall, och bidrar därmed med viktig information om vilka patienter som har nytta av adjuvant kemoterapi.
Taxaninducerad perifer neuropati kan förutses utifrån patienters genetik
Återfallsförebyggande behandling med taxaner förbättrar överlevnaden vid bröstcancer, men perifer neuropati är en vanlig och dosbegränsande biverkan. Efter avslutad behandling kvarstår perifer neuropati hos en del och påverkar då patienternas livskvalitet i hög grad. Nu har forskare vid Linköpings universitet utvecklat ett verktyg som kan förutsäga både hur hög och låg risken är för patienter att få kvarstående perifer neuropati. Risken för kvarstående biverkningar kan då vägas in i behandlingsval och i hur uppföljningen ska se ut för att minska denna risk.
Överlevnaden efter primär bröstcancer är hög, men även om de har överlevt sjukdomen har många kvar biverkningar orsakade av den onkologiska behandlingen. I en aktuell studie från Linköpings universitet har forskare studerat biverkningar efter taxanerna docetaxel och paklitaxel, som används för att förebygga återfall vid bröstcancer. Baksidan av den behandlingen är att en del patienter får kvarstående perifer neuropati, med symtom som känselpåverkan, smärta och svaghet i händer och fötter.
– Det är väldigt vanligt med biverkningar i form av nervskador efter behandling med taxaner vid bröstcancer och problemen kan kvarstå i flera år. Det har visats att symtomen har en stor inverkan på patienternas livskvalitet och kan också vara behandlingsbegränsande hos de som får recidiv. Det är ett stort kliniskt problem, som fått mer uppmärksamhet de senaste åren, men det har inte funnits något sätt att veta vilka individer som har störst risk för biverkningar, säger Kristina Engvall, nyligen disputerad vid Linköpings universitet och läkare på onkologkliniken vid Länssjukhuset Ryhov i Jönköping.
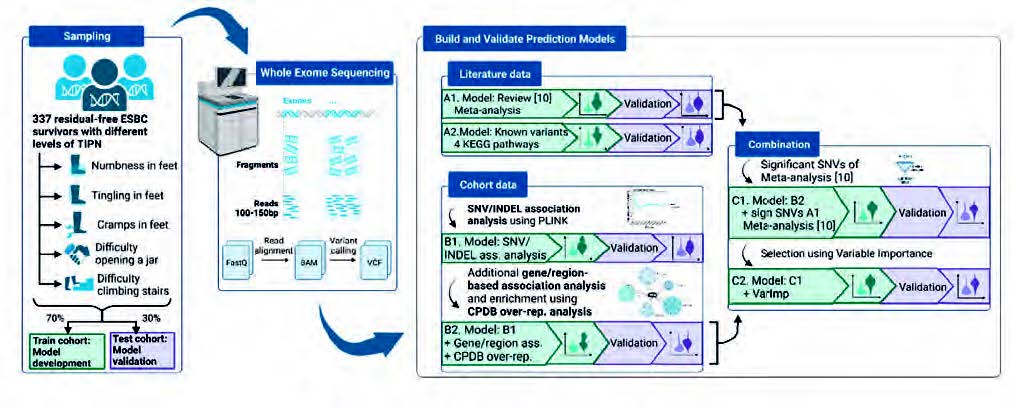
Flödesschema över metodupplägget av studien. Figur från Engvall, K., Uvdal, H., Björn, N., Åvall-Lundqvist, E., & Gréen, H. (2024). ”Prediction
models of persistent taxane-induced peripheral neuropathy among breast cancer survivors using whole-exome sequencing”. NPJ Precision Oncology, 8(1). https://doi.org/10.1038/s41698-024-00594-x. CC-BY-NC.
Studien baserades på en tidigare enkätstudie bland kvinnor som i median 3,6 år tidigare taxanbehandlats för bröstcancer. Symtomen rapporterades med enkäten EORTC CIPN20 som rekommenderas för studier på cytostatikaorsakad perifer neuropati. Vanliga symtom av högre grad var kramp i fötterna som var fjärde patient upplevde. Andra biverkningar var svårigheter att öppna en burk, domningar i fötterna, stickningar i fötterna och svårigheter att gå i trappor pga. svaghet i benen. Hälften av deltagarna i enkätstudien lämnade därefter ett blodprov som helexomsekvenserades, en analys av de kodande delarna av DNA. Efterföljande genetiska analyserna på kohorten involverade associationsanalyser mellan genetiska markörer och biverkningarna i kohorten. Markörer med tydligt samband till biverkningen analyserades vidare genom att associera genetiska regioner till biverkningarna och identifiera överrepresentation i biologiska nätverk och cellsignaleringsvägar. Baserat på tidigare kända gener förknippade med perifer neuropati och dessa genetiska analyser på kohortens data för att filtrera fram de genetiska varianterna som kopplas till kvarstående perifer neuropati kunde genetiska varianter med starkare koppling extraheras.




