Tidig cancerupptäckt är mer än screening. Screening räddar liv, men fångar långt ifrån alla cancerfall. Här har primärvården en avgörande roll. De flesta patienter som får en cancerdiagnos har sin första kontakt i primärvården.
De flesta som misstänker cancer och tar kontakt med vården, har inte cancer. Det gör tidig upptäckt till en balansgång: vi vill hitta signifikant cancer tidigare, men utan att överutreda så att resurser trängs undan och patienter utsätts för onödiga risker.
Som allmänläkare möter jag dagligen den här paradoxen. En enskild cancerdiagnos är ovanlig på vårdcentralsnivå, men cancer som fenomen är inte ovanligt. Utmaningen blir därför inte bara att “tänka cancer”, utan att göra det på ett sätt som är systematiskt, jämlikt och realistiskt i en verksamhet där tid, kontinuitet och diagnostiska resurser är begränsade.
För ungefär ett år sedan disputerade jag på hur symtom, fynd och vårddata kan bidra till tidigare upptäckt av cancer med avhandlingen Early Cancer Detection Through Symptoms and Signs på Karolinska Insitutet. Min avhandling utgick från en enkel fråga: går det att använda den information som redan finns i vården, symtom, diagnoskoder, laboratorievärden och vårdkontaktmönster, för att bättre identifiera patienter med förhöjd cancerrisk i primärvården?
Syftet är inte att skapa ett diagnosverktyg, utan att utveckla riskbaserade varningssignaler som kan stödja kliniskt beslutsfattande, en ”heads-up” när kombinationer av fynd eller trender över tid gör att cancer bör finnas högre upp i differentialdiagnostiken.
Sedan dess har min forskning breddats, men med samma mål: att hjälpa primärvården att hitta rätt patienter tidigare, utan att driva fram mer överutredning och undanträngning.
Från selekterade patienter till verklig primärvård
I min avhandling studerade vi bland annat patienter med misstänkt lungcancer som remitterats till lungonkologisk mottagning. Innan de fick sin bedömning fick de svara på en omfattande symtomenkät. Vi undersökte om kombinationer av symtom och upplevelser kunde förutsäga vilka som faktiskt hade lungcancer. I analyserna tog vi också hänsyn till patienternas rökstatus. Det visade sig vara avgörande, eftersom samma symtom kan ha helt olika signalvärde för lungcancer hos rökare och hos personer som aldrig har rökt. Att kunna identifiera risk även hos aldrig-rökare är särskilt viktigt, eftersom lungcancer i denna grupp ofta upptäcks sent.
Det gav viktig kunskap, men det är också en population där primärvårdens urval redan är gjort. Prevalensen av lungcancer i gruppen var hög (cirka 60 procent), vilket gör att resultaten inte kan översättas rakt av till primärvården, där samma symtom ofta betyder något helt annat.
Just därför bygger vi nu vidare på studien på ett sätt som närmar sig primärvårdens verklighet. Vi jämför den selekterade remisspopulationen med befolkningskontroller och kopplar på biomarkörpaneler. Frågan är om vi, med hjälp av symtomkombinationer och enkla blodprov, kan bli bättre på att identifiera vilka patienter som har hög risk för lungcancer, i en befolkning där cancer är relativt ovanligt?
Bättre struktur i uppföljning av högriskindivider
En närliggande men ofta förbisedd del av tidig cancerupptäckt handlar om patienter med mycket hög cancerrisk eller tidiga, lågprogressiva fynd, där målet inte är omedelbar behandling utan strukturerad uppföljning. Det gäller till exempel personer med cystor i pankreas, lungnoduli, slemhinneförändringar i munhålan eller låg-risk prostatacancer som följs i aktiv monitorering.
För dessa patienter är utmaningen att skapa arbetssätt som är jämlika, patientsäkra och resurseffektiva. Att säkerställa att uppföljning faktiskt sker, att risken för både över- och underbehandling minimeras, och att vi kontinuerligt utvärderar om våra strategier gör nytta snarare än skada. Jag är involverad i flera projekt som rör dessa grupper, både som forskare och i min roll som nationell samordnare för tidig upptäckt av cancer.

Patienternas rökstatus visade sig vara avgörande, eftersom samma symtom kan ha helt olika signalvärde för lungcancer hos rökare och hos personer som aldrig har rökt.
Nyttan med “rule-out”-verktyg i primärvården
I primärvården är behovet ofta inte enbart att identifiera patienter med förhöjd cancerrisk, utan att kunna prioritera rätt. Ett test med högt positivt prediktivt värde kan vara svårt att hitta när prevalensen är låg. Däremot kan analyser med högt negativt prediktivt värde vara mycket kliniskt användbara.
I dag är det ofta just “rule-out”-prover som har allra störst praktisk nytta: D-dimer för att kunna utesluta venös tromboembolism i rätt kliniskt sammanhang, och troponin för att kunna utesluta hjärtinfarkt. Kan vi använda ett motsvarande tänk för cancer, eller åtminstone för vissa cancerformer, i vissa symtomgrupper?
Om primärvården hade bättre verktyg för att tryggt kunna säga “det här talar starkt emot cancer”, skulle det kunna minska onödiga remisser och utredningar, frigöra resurser och samtidigt öka patientsäkerheten genom att de patienter som behöver utredas snabbare också kan prioriteras tydligare.
En annan väg till tidig upptäckt – förstå varför det tar för lång tid
Parallellt med biomarkör- och riskmodellsspåret har vi också närmat oss tidig upptäckt från “andra hållet”, vad är det som gör att diagnosen ibland dröjer, trots upprepade kontakter?
Tillsammans med Rita Fernholm, chefsläkare på SLSO, driver jag ett projekt för att analysera vårdavvikelser inom primärvården i Stockholm med fokus på diagnostik. Enligt svensk lag ska avvikelser rapporteras, men bara de mest allvarliga händelserna anmäls som lex Maria. Majoriteten av avvikelserna hanteras lokalt på enheten, och kunskapen stannar ofta där.
Vi har velat undersöka vad vi kan lära oss om vi samlar erfarenheter från flera vårdcentraler. Finns återkommande mönster ur ett systemperspektiv? Handlar det om kontinuitet, tillgänglighet, arbetsmiljö, provsvarshantering, kommunikation, remissflöden, eller något annat? Målet är inte att peka finger, utan att identifiera förbättringsområden där relativt enkla systemförändringar kan göra stor skillnad.
Som komplement har vi också låtit vårdcentraler, mot ersättning, göra slumpvisa journalgranskningar utifrån fördefinierade kriterier, kopplade till vissa utvalda symtomdiagnoser. Skälet är enkelt, vi vet att inte alla missar eller fördröjningar avspeglas i avvikelsesystemen. Journalgranskning kan fånga “missade möjligheter” som annars aldrig syns i statistiken. Målet är att gå från enskilda berättelser till systematiskt lärande, att se återkommande mönster och förstå vilka delar av processen som ofta brister, så att förbättringar kan göras brett, inte bara lokalt på en enskild vårdcentral.
Vad betyder en symtomdiagnos? Och vad missar vi i kodningen?
I flera av avhandlingsstudierna utgick vi från diagnossatta symtom, tecken och sjukdomar i registerdata. Det är viktigt att komma ihåg att en symtomdiagnos i sig ofta speglar ett kliniskt övervägande, läkaren har bedömt symtomet som tillräckligt relevant för att sätta en kod, och det följs inte sällan av någon form av utredning eller behandling.
Samtidigt är ett grundproblem att symtomdiagnoser bara speglar det som faktiskt kodas, och vi vet att bara en liten del av det som diskuteras under ett besök blir symtomkodat. Det väcker en viktig metodfråga, men också en praktisk fråga. Hur påverkar det vår förmåga att använda vårddata för riskbedömning? Om fritexten innehåller mer information än koderna riskerar vi att bygga modeller som i första hand speglar dokumentationsmönster och kliniska prioriteringar, snarare än patientens fulla symtombild.
Därför har vi ett samarbete med forskare på KTH där vi analyserar journalens fritextdata och undersöker hur detta kan påverka prediktion av cancer. Min allmänläkarkollega Eliya Abedi driver en stor del av detta arbete och planerar att disputera i slutet av 2026. Här hoppas vi både kunna förbättra modellerna och förstå hur man kan göra dem mer rättvisa och kliniskt relevanta.
Primärvårdsnära cancerforskning
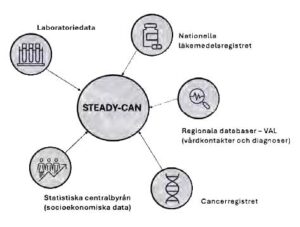
Figur. Översikt av datakällor i STEADY-CAN-kohorten. Figuren illustrerar hur kliniska data från primärvård och specialistvård, laboratoriedata, läkemedelsdata, cancerregister samt socioekonomiska data från Statistiska centralbyrån länkas i den populationsbaserade STEADY-CAN- kohorten. Figuren är modifierad från Nemlander et al., European Journal of Epidemiology, 2025.
Sist, men inte minst, har vi byggt upp en stor databas, Stockholm Early Detection of Cancer Study, STEADY-CAN, som jag leder. Den innehåller cancerdata, socioekonomiska data samt hälso- och sjukvårdsdata från både primärvård och sjukhusvård (besök, diagnoskodning, förskrivningar och laboratoriedata från de tre aktiva laboratoriebolagen i Stockholm) över mer än ett decennium.
Det fina med en sådan kohort är att den möjliggör många parallella studier som kan svara på frågor som annars är svåra i primärvård, just eftersom cancer är relativt ovanligt per enskild vårdcentral. I slutet av 2025 tilldelades jag Vetenskapsrådets sexåriga karriärbidrag till forskare inom primärvården kopplat till STEADY-CAN, ett välkommet stöd som ger långsiktighet och möjliggör flera spår samtidigt.
Den nyligen publicerade nationella cancerstrategin 2.0 betonar att fler behöver diagnostiseras tidigt, att vården ska vara jämlik och att forskning och innovation är avgörande för framtidens cancervård. Strategin pekar särskilt ut primärvården som en nyckelaktör i den symtombaserade vägen till diagnos.
Det är i detta sammanhang jag ser min fortsatta forskning. Att bidra med evidens, verktyg och systemkunskap som gör det möjligt att identifiera patienter med förhöjd cancerrisk tidigare, utan att öka överutredning eller undanträngning. För att lyckas krävs långsiktiga satsningar på primärvårdsnära forskning och en tydlig koppling mellan data, klinik och patientens behov.
Det är i den vardagen, där de flesta patienter inte har cancer men där de flesta cancerpatienter börjar, som framtidens tidiga upptäckt måste fungera.